Adicionalmente, podemos apoyarlos de las siguientes formas:
- Tramitar los permisos correspondientes para la importación.
- Actuar como importador autorizado en caso de que cuenten con contacto directo con el CRO.

¿Qué es un protocolo de investigación?
Es un documento que describe cómo se debe llevar a cabo un estudio clínico (para desarrollo de nuevos medicamentos).
Define los objetivos, diseño, metodología, consideraciones estadísticas y organización general del ensayo.
Los principales actores involucrados son:
- Sponsor (Patrocinador)
- CRO (Contract Research Organization): Empresa que actúa en nombre del sponsor, gestionando aspectos operativos y logísticos del estudio.
- Laboratorio Central: Generalmente ubicado en EE.UU., es responsable del procesamiento y análisis de las muestras biológicas.
- Importador Autorizado: Esta registrado y autorizado ante COFEPRIS para realizar la importación de medicamentos, kits médicos y demás insumos del protocolo. Tramita los permisos sanitarios y realiza el despacho aduanal.
- Sitios de Investigación (Hospitales, Clínicas, Centros):Son los lugares donde se ejecuta el protocolo, se atienden a los pacientes y se recolectan las muestras.

Logística en protocolos de investigación
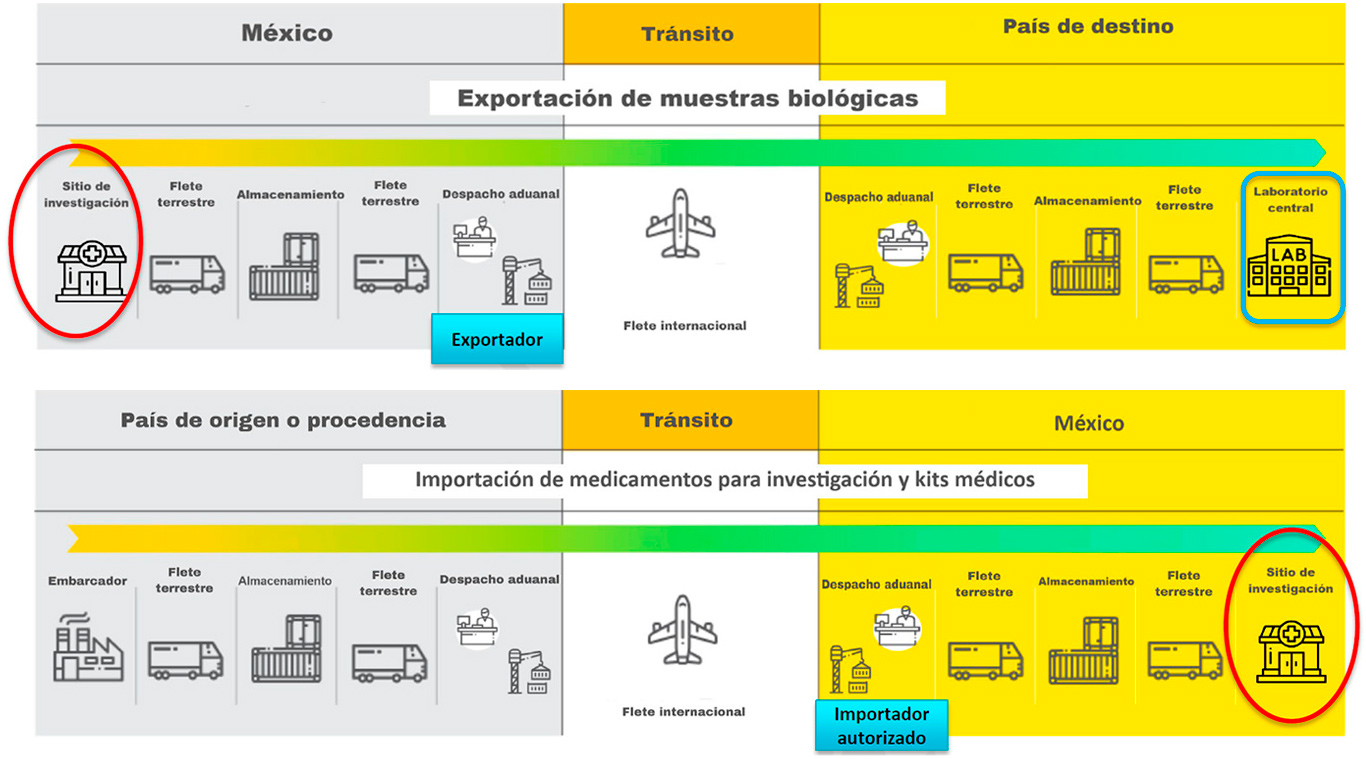
Flujo de materiales hacia México (importación)
Los kits médicos (vacutainers, tubos, viales) y los medicamentos de investigación llegan desde EE.UU. u otros países al sitio de investigación en México.
Estos requieren permisos sanitarios para el despacho aduanal
Permisos requeridos para la importación de medicamentos de investigación.
Cuando un medicamento entra al país exclusivamente para ser utilizado en un protocolo de investigación autorizado, NO se requiere registro sanitario (como sí lo exige un medicamento comercial), pero sí se requiere un permiso específico.
Permisos requeridos:
1. Autorización del protocolo por COFEPRIS
2. Permiso de importación para medicamento de investigación
Permisos requeridos para la importación de kits médicos (materiales auxiliares de estudio)
Los kits médicos son indispensables para recolectar o procesar muestras: tubos, hisopos, lancetas, contenedores de recolección, sobres térmicos, etc.
Permisos requeridos:
1. Permiso de importación por COFEPRIS (cuando aplica): Si los kits contienen materiales de uso médico. Si no hay contacto directo con el cuerpo o no tienen riesgo sanitario, pueden ingresar como insumos sin necesidad de registro o mediante Regla 3.13 (RGCE) si cumplen con los requisitos.
2. Carta de justificación técnica del sponsor o CRO: Documento que explica que los kits no tienen valor comercial, que serán usados en un protocolo autorizado y que no serán vendidos ni distribuidos.
Consideraciones adicionales:
Etiquetado:
• Si es medicamento, debe estar identificado como "Medicamento en Investigación – uso exclusivo para ensayo clínico".
• Los kits deben llevar etiquetas internas y externas si contienen componentes biológicos o peligrosos.
Transporte:
• Si se requiere cadena de frío, debe demostrarse que el empaque mantiene temperatura adecuada.
• Si lleva hielo seco (UN 1845), se debe declarar como mercancía peligrosa clase 9.
Flujo de materiales desde México (exportación)
• Muestras biológicas (sangre, plasma, orina, tejido) recolectadas en los sitios de investigación se exportan a laboratorios centrales.
Estas muestras se consideran materiales biológicos potencialmente peligrosos y están reguladas como tal, bajo el UN 3373 – Biological Substance, Category B.
• El tiempo estimado normal del traslado desde el sitio hasta USA es de 24 horas aprox.
